
Асистираните репродуктивни технологии са съвкупност от клинични и биологични процедури, които позволяват зачеване ин витро (IVF), ICSI, трансфер на ембриони и изкуствена инсеминация. С тяхна помощ може да се роди дете в семейство, на което е невъзможно или малко вероятно да постигне бременност по друг начин.
Ин витро оплождането (IVF) e метод, при който в лабораторни условия яйцеклетките на съпругата се събират със сперматозоиди на нейния съпруг, за да се оплодят. Получените ембриони се прехвърлят в матката на съпругата или се замразяват (криопрезервация).
Методът ICSI е подобен на метода IVF, но при него в яйцеклетката се инжектира сперматозоид с помощта на специална техника.
IVF/ ICSI се извършва на следните етапи:
1. Индукция на овулацията.
2. Събиране на яйцеклетки.
3. Получаване на сперматозоиди.
4. Събиране на яйцеклетките и сперматозоидите в лаборатория и осигуряване на условия за оплождане и ранен растеж на ембриона.
5. Трансфер на ембрионите в матката.
Индукция на овулацията
Успехът на метода IVF зависи до голяма степен от качеството и броя на събраните яйцеклетки. Чрез индукция на овулацията с хормонални препарати лекарският екип контролира зреенето на яйцеклетките и повишава шанса за събиране на повече от една яйцеклетка. Медикаментите и дозите се определят индивидуално за всяка пациентка. Понякога при приложението на тези медикаменти настъпват странични ефекти като гадене, главоболие, горещи вълни. Както с всички други лекарства, така и в този случай е възможно и развитие на алергична реакция. Проследяването на овулацията се извършва основно чрез хормонални изследвания (естрадиол, лутеинизиращ хормон), ехографии (безболезнен преглед с ултразвук), влагалищна цитонамазка, цервикален скор и други изследвания.
Пункция на фоликули
Целта на пункцията на фоликули е събирането от яйчниците на яйцеклетки, които да бъдат оплодени. За да се съберат по-качествени яйцеклетки се прави инжекция с хормона човешки хорионен гонадотропин (ЧХГ). Дозата и времето на поставяне на ЧХГ се определя от лекарския екип. Към пункцията на фоликули се пристъпва от 32 до 36 часа по-късно. Методът е известен като трансвагинално събиране на яйцеклетки под ехографски контрол (събиране на яйцеклетки под ехографски контрол през влагалището) е безболезнен благодарение на използването на определени медикаменти, които могат да се приложат през устата, мускулно или венозно. През влагалището се въвежда специална игла, която се насочва под ултразвуков контрол към фоликулите на яйчниците. Събраните с тази игла яйцеклетки се предават веднага на биолог, който прави оценка на качеството им и след като потвърди, че са зрели, осигурява подходящите условия за тяхното оплождане. Възможно е въпреки добрите резултати от ултразвуковите и хормонални изследвания да не бъдат извадени яйцеклетки. По време на стимулацията могат да се образуват наред с другите фоликули и кистични, които не съдържат яйцеклетка. Естрадиолът се синтезира от клетките около яйцеклетката – кумулусни клетки. Макар и не много често, се случва фоликулът да съдържа такива клетки без да съдържа яйцеклетка, наречени на жаргон „кухи”. За точния брой аспирирани яйцеклетки се разбира около час след фоликулярната пункция. Преди това, както и по време на самата стимулация, броят на водещите фоликули и естрадиолът са само косвени и ориентировъчни показатели за това колко са яйцеклетките.
Задължително е извършването на предоперативни изследвания и прегледи.
Лабораторен етап
Използват се яйцеклетките на съпругата и сперматозоидите на съпруга или на донор, които са получени чрез мастурбация или от криобанка към съответната клиника. В случай че липсват сперматозоиди в еякулата, такива могат да бъдат извлечени по оперативен път (TESE, PESA), от урината – в случай на ретроградна еякулация, чрез електростимулация в случаи на парализа, импотентност, психологическа бариера и т.н. Инсеминирането (добавянето на сперматозоиди) на яйцеклетките се извършва няколко часа по-късно след тяхното изваждане.
Когато процедурата е конвенционално ин-витро оплождане спермата търпи т. нар. „обогатяване”. Тази обработка е задължителна както при тази процедура, така и при вътрематочните инсеминации, т. к. подобно и на естествения път на зачеване, цели отстраняването на мъртвите сперматозоиди, левкоцитите, бактериите и семенната плазма, които са вредни за яйцеклетката и на практика не са в контакт с нея. В природата, по аналогичен начин, тази обработка се осигурява на входа на матката, в цервикалния канал и от цервикалната слуз. Така обогатената само на добре и активно-подвижни сперматозоиди фракция се добавя под микроскоп към комплекса яйцеклетка-кумулусна маса (фиг. 1).
Тази фракция (фиг. 2) може да се извлече само от добро изходно състояние на еякулата и/или много леки отклонения от нормалните параметри. Поставени към този коплекс, сперматозоидите с часове разграждат тази маса (фиг. 3) и само един от тях успява да проникне в яйцеклетката. И въпреки, че ин-витро оплождането се счита за изкуствено оплождане, всъщност яйцеклетката „избира” сама сперматозоида - дали да го пропусне и кой точно да навлезе в нея, както е в природата.
 |
 |
 |
|
|
Фиг. 1
|
Фиг. 2
|
Фиг. 3
|
Недостатъчната концентрация или процент на добре подвижните сперматозоиди в изходната фракция водят до малко на брой активно-подвижни сперматозоиди след обработката (фиг. 4). Този факт води след себе си - липса на оплождане при всички яйцеклетки или при по-голямата част от тях, ако се проведе конвенционално ин-витро оплождане. 
Фиг. 4
Ето защо, практиката е наложила използването на ICSI техниката – разновидност на IVF, която се отличава от конвенционално ин-витро оплождане по няколко белега.
ICSI (ИКСИ)
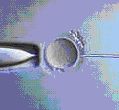
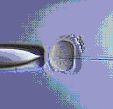
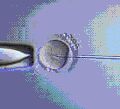
1. Провеждането на ICSI в сравнение с IVF се състои в директното въвеждане на един сперматозоид в яйцеклетката. Манипулацията се извършва с помощта на микроигла (представлява микропипета, чрез която се улавя и засмуква единичен добре оформен и витален сперматозоид) под микроскопски контрол с помощта на управляван от ембриолог - микроманипулатор. 
Фиг. 5
2. За целта е нужна предварителна подготовка на яйцеклетките за ICSI – отстранява им се обкръжаващата ги маса от клетки, т. к. тя не може да бъде разградена сама от недостатъчния брой сперматозоиди. От друга страна, нейното отстраняване е задължително, за да може яйцеклетката да се позиционира добре преди самото инжектиране. Това ориентиране се налага, за да не се увреди яйцеклетката при въвеждането на сперматозоида. 
Фиг. 6
3. Използването на микроманипулатор – без него тази процедура е невъзможна. Също така и опита на ембриолога, обучен за нейното прилагане е от изключителна важност.
 |
 |
|
Фиг. 7
|
Фиг. 8
|
 |
 |
|
Фиг. 9
|
Фиг. 10
|
4. Използването на еднократни микро-пипети, които от едната страна придържат яйцеклетката неподвижна, а от другата – въвеждат сперматозоид. Подбраният сперматозоид трябва да е витален и по възможност с добра морфология, за да се осигури добър процент на оплодени яйцеклетки, спрямо извадените такива. 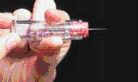
Фиг. 11
Сперматозоидът може да произлиза от спермата на съпруга.
Когато в спермата липсват сперматозоиди, последните могат да бъдат изолирани от епидидима или директно от тестиса.
PESA е подкожно аспириране на сперматозоиди от епидидима (депо, в което се събират зрелите сперматозоиди). Тази неинвазивна процедура е различна от операцията и трае няколко минути. Прави се, при запушване на семепроводите (обструктивна Azoospermia) или след вазектомия т. е. когато има еякулат, но в него липсват сперматозоиди. Тази проба може след аспирацията да бъде замразена и на последващ етап отмразена с цел да се инжектират яйцеклетките на съпругата с нея (ICSI), т. к. фракцията от епидидима е крайно недостатъчна като количество и капацитет да осъществи конвенционална ин-витро процедура или инсеминация. От друга страна тази манипулация може да доведе до извличането на зрели морфологично и генетично сперматозоиди с много добра виталност. 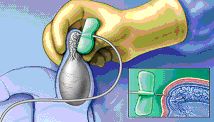
Фиг. 12
TESE - екстракция на сперматозоиди след оперативно взимане на тъкан от тестисите. Прави се, когато има запушване на семепроводите (обструктивна Azoospermia) и липсват сперматозоиди след PESA, както и при много тежка Oligoathenozoospermia и необструктивна Azoospermia – директно в тъканта се търсят сперматозоиди, както и незрели гамети - сперматиди. Тази проба може след аспирацията да бъде замразена и на последващ етап отмразена, но в много от случаите преживяемостта на тестикуларна тъкан след размразяване е ниска. Ето защо се препоръчва да се прави и в деня на изваждането на яйцеклетки от съпругата. ICSI е последващ етап от тази манипулация, т. к. фракцията от тестисите е недостатъчна да осъществи конвенционална ин-витро процедура или инсеминация.
 |
|
|
Фиг. 13
|
Фиг. 14
|
ELSI, ROSI - това са методи на инжектиране на незрели сперматозоиди (elongated spermatid injection, round spermatid injection) в яйцеклетките. Прави се след PESA или TESE и замества ICSI процедурата, когато липсват зрели сперматозоиди (арест в сперматогенезата) или са недостатъчен брой за извадените яйцеклетки при тежка отклонения в сперматогенезата. 
Фиг. 15
Култивиране и трансфер на ембриони
В инкубатор яйцеклетките остават максимално до шест дни след пункцията на фоликули, като периодично се прави оценка дали е настъпило оплождане и как протича деленето на оплодената яйцеклетка.
Общо и за всички процедури е култивирането на ембрионите:
1. Ден първи - е денят след аспирацията на яйцеклетките. Определено време след въвеждането на сперматозоидите се проверява за наличието на оплождане, какъв е процента на оплодените яйцеклетки, нормално ли са оплодени и т. н. ![]() Ден първи
Ден първи![]()
Фиг. 16
2. Следят се ембрионите на различни етапи от тяхното развитие. Спрямо това, колко са на брой, как се развиват, какво е качеството им и не на последно място каква е методиката, която следва даден екип, тяхното връщане в матката може да се състои на някой от следните етапи: ![]() Ден втори
Ден втори
|
|
|
|
Фиг. 17
|
Фиг. 18
|
![]() Ден трети
Ден трети
Фиг. 19 ![]() Ден четвърти
Ден четвърти
Фиг. 20 ![]() Ден пети
Ден пети![]()
Фиг. 21
Трансферът на ембриони има за цел поставянето на оплодените яйцеклетки (ембриони) в маточната кухина.
След няколко последователни деления се пристъпва към прехвърлянето им в матката. Тази манипулация е наречена трансфер на ембриони. Този етап е най-краткият от цялата технология на асистираната репродукция, но е и един от най-важните. Извършва се от два до пет дни след пункцията на фоликули.
Ембрионът се поставя в много тънка тръбичка под микроскопски контрол и внимателно се въвежда в матката. 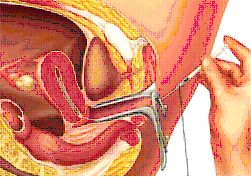
Фиг. 22 
Фиг. 23
Спокойствието на пациентката в този момент е много важно, за да се улесни преминаването на тръбичката през шийката на матката и за да се избегне появата на маточни контракции, които биха могли да изместят току-що поставения ембрион на неподходящо място в матката.
Имплантацията на поставените след в матката ембриони настъпва 1-3 дни по-късно въз основа на т. нар. „матка-ембрион-диалог”, който е подчинен на поредица от имунологични и молекулно-клетъчни взаимодействия. Около две седмици по-късно се установява за евентуално настъпилата имплантация и последваща бременност.
Когато има повече оплодени яйцеклетки, най-качествените от тях се прехвърлят в матката на жената, а останалите могат да се замразят или да бъдат унищожени (т. к. в инкубатор, извън матката, те са способни да живеят максимум шест дни). Това зависи изключително от желанието на двамата партньори и възможностите за това.
Шансовете за настъпване на бременност са по-високи при трансфериране на повече ембриони и при ембриони с по-добро качество. От друга страна, колкото повече ембриони се трансферират, колкото по-добро е качеството им, толкова по-голяма е вероятността за възникване на многоплодна бременност.
Многоплодната бременност, както и манипулациите по редуциране на броя на имплантираните ембриони, крият рискове за развитието на бременността, риск за всичките плодове и за състоянието на бременната, включително и за живота й. Това е причината лекарският екип да търси баланс при трансфера на ембриони между повишаването на възможността за имплантация и ограничаване на случаите с множествена бременност в рамките най-много на двуплодна (5-8% от всички случаи).
В световен мащаб все повече се налага трансферът на 1 или максимум 2 ембриона. За България все още няма такива ограничения, но в повечето центрове максимумът е 3. Високият процент многоплодни бременности е рисков и на този етап България е на едно от челните места по процент на многоплодни бременности от АРТ. За висока честота на триплодни бремености се счита повече от 2.5% при АРТ. За България този процент е 8,5% - повече от три пъти по-висок (по данни на ESHRE: IVF monitoring & Data Collection 2001).
Успеваемостта от IVF/ICSI процедурата зависи от много фактори, най-важният от които е възрастта при жената. Процентът бременност на един цикъл на една ин-витро процедура при жена под 37 години е около 20-25%. След няколко ин-витро опита (до 6) при една и съща жена този процент достига 60%, но тогава се изчислява % на пациент, а не за един цикъл. При жени над 40-42 г. успеваемостта е около 10% на един ин-витро цикъл. Колкото е по-млада една жена, толкова по-лесно се поддава на стимулация, отговорът на яйчниците е по-добър, което респективно води и до получаването на качествени яйцеклетки и в последствие ембриони. Разпределени по възрастови категории, най-висок % бременности на 1 цикъл имат жените между 20 и 25 г. – около 35%-40%. За да се изчисли реалният % на бременности е необходима достатъчно голяма и рандомизирана група пациенти (над 100 цикъла) - без селекция по възраст, отговор на стимулация, перспективност, брой извадени яйцеклетки, брой и качество на получени ембриони и т. н.
От проучванията на белгийския екип, създал първото ICSI бебе в света (Palermo and Van Steirteghem) през януари 1992, бе направена следната равносметка на конгрес в Белград през декември 2004 г.: 12 години по-късно.
Заключение: Няма сигнификантна разлика в процента на конгенитални малформации при родените деца и в процента на малформациите при деца на 2 и 5 годишна възраст – от процедури ICSI (n=2840), IVF (n=2955) и от контролната група - естествено заченати деца. (Става въпрос за родените вече деца и навършили 5 годишна възраст).
| Основни характеристики | FSH* | rFSH* |
| Възраст на жената | 30,8±4,2 | 30,8±4,2 |
| Давност на стерилитета в месеци | 45,5±28,5 | 44,9±29,3 |
| Дни терапия | 11,5±1,9 | 11,5±2 |
| Брой ампули | 36,9±10,9 | 37,1±10,8 |
| Брой фоликули над 16мм | 8,1±5,1 | 8,4±5,9 |
| Брой асп. яйцеклетки | 12,8±7,3 | 13,9±3 |
| Брой върнати ембриони | 2,3±0,8 | 2,3±0,7 |
| Биохимични бременности | 31,9 % | 29,2 % |
| Клинични бременности | 26,6 % | 22,6 % |
| Развиващи се бременности | 23,8 % | 21,1 % |
FSH – фоликул стимулиращ хормон - С цел да не се комерсиализира тази статия, изнесените резултати не съдържат имената на използваните медикаменти за стимулация.
Автор: Таня Милачич
МЦ "Репродуктивно здраве" - София
В настоящата статия са използвани някои материали на Българската Асоциация по Стерилитет и Репродуктивно здраве, микроскопски снимки от Istanbul Memorial Hospital, Cornell University – Medical Department of Urology, Research Instruments.